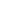4月15日,國家藥監(jiān)局官網發(fā)布《重組膠原蛋白類醫(yī)療產品分類界定原則》(以下簡稱《原則》),規(guī)范對重組膠原蛋白類醫(yī)療產品管理屬性和管理類別的判定。
管理屬性的界定
《原則》指出,重組膠原蛋白類醫(yī)療產品的管理屬性應當依據產品預期用途、作用機制等進行綜合判定。
(一)不符合《醫(yī)療器械監(jiān)督管理條例》有關醫(yī)療器械定義的重組膠原蛋白類產品,不作為醫(yī)療器械管理。
(二)產品實現醫(yī)療器械用途,同時含有發(fā)揮藥理學作用的藥物成分時,應當根據產品主要作用機制判定以藥品作用為主或者以醫(yī)療器械作用為主的藥械組合產品。以藥品作用為主的藥械組合產品,按照藥品申報注冊;以醫(yī)療器械作用為主的藥械組合產品,按醫(yī)療器械申報注冊。
(三)產品符合醫(yī)療器械定義且不含有發(fā)揮藥理學作用的藥物成分時,作為醫(yī)療器械管理。
醫(yī)療器械管理類別的界定
《原則》明確,對于屬性判定作為醫(yī)療器械管理的重組膠原蛋白類醫(yī)療產品,應當依據產品的材料特性、結構特征、預期用途、使用形式等綜合判定產品管理類別。
(一)重組膠原蛋白類產品的管理類別應當不低于第二類。
(二)重組膠原蛋白類產品作為無源植入物應用時,應當按照第三類醫(yī)療器械管理。
(三)重組膠原蛋白類產品作為止血和防黏連材料應用時,若產品可部分或全部被人體吸收或者用于體內時,按照第三類醫(yī)療器械管理;若產品不可被人體吸收且僅用于體表時,按照第二類醫(yī)療器械管理。
(四)重組膠原蛋白類產品作為醫(yī)用敷料應用時,若產品可部分或者全部被人體吸收,或者用于慢性創(chuàng)面,按照第三類醫(yī)療器械管理;若產品不可被人體吸收且用于非慢性創(chuàng)面,按照第二類醫(yī)療器械管理。
重組膠原蛋白類產品的分類編碼應當根據產品的預期用途,參照《醫(yī)療器械分類目錄》予以確定。
注冊審批要求
對于重組膠原蛋白類醫(yī)療產品的注冊審批,《原則》要求如下。
(一)自本原則發(fā)布之日起,重組膠原蛋白類醫(yī)療產品應當按照上述要求申請注冊;已按照醫(yī)療器械受理注冊申請的產品,繼續(xù)按照原受理類別進行審評審批。
(二)對于已獲準按照醫(yī)療器械注冊的重組膠原蛋白類產品,其注冊證在有效期內的仍將繼續(xù)有效。
(三)在注冊證有效期內提出注冊申請的,如在開展產品類別轉換期間注冊證到期的,注冊人可向原審批部門提出原注冊證的延期申請;予以延期的,原注冊證有效期原則上不得超過2023年12月31日。
來源:藥監(jiān)局




 全部商品分類
全部商品分類